新型コロナウイルスで脚光を浴びる「VHH抗体」とは?

こんにちは! バイオニアです。
本日は、新型コロナウイルスの感染抑制能を持つ抗体の開発により話題となった、「VHH抗体」について紹介していきます。
私も大学院生時代に、新規VHHの探索研究に携わった経験がありますが、まさかTwitterのトレンドにVHH抗体がランクインする日が来るとは夢にも思っていませんでした(思わずスクショを撮ってしまいました笑)。

VHHについての理解を深めるためにまず、「抗体の構造」と「低分子抗体」について、説明させて下さい。(既にご存知の方は読み飛ばしてください。)
私がブログを書いている目的の一つは、生物のバックグラウンドのない一般の方にも、興味深い生命科学の技術・情報を伝えることなので、初学者にも分かりやすいような説明を心がけました。分からなかったところなども、コメント頂けますと嬉しいです。
目次
抗体の機能と構造
生体は、内部に侵入した異物を捕らえ、自己と非自己を認識し、非自己を生体外へ排出する「免疫」機構を備えています。抗体は、この免疫機構の中枢を担っており、抗原に対して特異的に結合するタンパク質です。
抗体は免疫グロブリン(Immunoglobulin:Ig)と呼ばれ、IgGをはじめとするIgA 、IgD 、IgE 、IgMの5つのクラスに分類されています。その中でも、抗体医薬品としても用いられるIgGの構造を下図に示します。

いずれのクラスの抗体も、基本構造として重鎖(Heavy chain:H鎖)及び軽鎖(Light chain:L鎖)からなり、2本のH鎖とL鎖がジスルフィド結合や非共有結合により構成されてY字型の構造を取っています。
この中でも、各鎖のN末端側(Y字の二股に分かれた先の部分)はアミノ酸配列の類似性が低いため、可変領域(Fragment of variable region:Fv)と呼ばれます。可変領域(Fv)は重鎖と軽鎖それぞれに存在し、それぞれVH、VLと言います。
このVH, VLは、相補性決定領域(Complementarity Determining Region:CDR)と呼ばれるそれぞれ3ヶ所のループ部分を有し、CDRのアミノ酸配列の違いにより、多種多様な標的分子への特異性を創出しています。
抑えるべきポイント:
・抗体は免疫機能の中枢を担うタンパク質。
・標的分子への結合に関与するのは、Fvと呼ばれる領域。
結合ドメインに着目した抗体の低分子化技術
抗体をがんや難治性感染症などの分子標的治療薬として利用する際には、腫瘍への浸透性を高めるために、低分子化が望まれることがあります。また、PETイメージングや薬物送達システム(Drug Delivery System:DDS)への応用では、抗体の標的分子に対する高特異性、高親和性という特徴のみが求められ、時には速いクリアランスが必要な場合もあります。
そのため、プロテアーゼを用いて抗原結合性断片(Fragment antigen binding:Fab)やF(ab’)2を作製する技術や、最小単位であるFvやFvをペプチドリンカーで繋いだ一本鎖Fv(single-chain Fv:scFv)などの低分子化設計が提案されてきました。
下図に、開発されている主な低分子化抗体と、細胞間隙経路のサイズを示します。

scFvのサイズは約3.5 nmであり、IgGの15 nmと比較して小さいです。これは、毛細血管及びリンパ管から吸収される大きさであり、腫瘍の深部まで浸透することが可能です。一方で、*腎糸球体によるろ過を受けるサイズであるため、クリアランスが早い特徴があります。
*腎糸球体ろ過
腎臓は、血液中の老廃物や塩分をろ過し、尿として体外に排出する働きがあります。この働きをしているのが糸球体であり、細い毛細血管が毛糸の球のように丸まっています。糸球体はふるいのような役割を持ち、腎臓に流れ込んできた血液が糸球体を通ると老廃物がろ過されます。そして赤血球や高分子量のタンパク質等はろ過されず、きれいになった血液が腎臓から出ていきます。
腎糸球体基底膜の影響により、IgG型の抗体はろ過されにくいため生体内半減期が長く、低分子抗体はろ過されるため半減期が短いです。半減期を長期化するために、低分子抗体のPEG化やFcRn結合性の付与設計などが試みられています。
VHH抗体の構造と機能
上述のように、通常脊椎動物が持つ抗体は、重鎖と軽鎖がジスルフィド結合や非共有結合を持つことで構造を形成しています。
しかし、1993年に初めて報告されたラクダ抗体は、重鎖のみから形成され、さらに重鎖定常領域であるCH1ドメインを持たない抗体でした。(ラクダが有する抗体のすべてが重鎖抗体で構成される訳では無く、他の脊椎動物と同じように軽鎖を有する抗体も存在しており、アルパカでは約50%が重鎖抗体であると報告されています。)

この中でも、実際に応用を目指して検討が進んでいるのは重鎖抗体の可変領域であるVHH(Variable domain of Heavy chain of Heavy chain antibodyの略)抗体です。シングルドメインで標的分子に結合する低分子抗体であり、以下のような長所を有することが分かっています。
(1)構造安定性が高く、熱変性や凝集が少ない
(2)変異導入に対して高い寛容性がある
(3)シングルドメインであるためにエンジニアリングが容易
(4)安価に大量生産が可能
(5)動物免疫を利用して、親和性向上の起点となる分子を取得可能
その他、基本特許が2013年に失効していることも、研究を後押しする一因となっています。
また、VHH抗体を語るうえで切っても切り離せないのがAblynx社です。この会社はVHH抗体の基本特許使用権を有していましたが、2018年にフランスのメガファーマであるSanofi社が、約5300億円で買収しています。このことは、VHH抗体の将来性を物語っています。
VHH医薬の上市状況
VHH抗体医薬の上市状況を下表にまとめました。シングルドメイン単独ではなく、HSA(ヒト血清アルブミン) に結合するVHHの連結やPEG化によって、体内での動態を良くしようと設計しているようです。

2019年には、Ablynx社(現Sanofi)から後天性血栓性血小板減少症の治療薬であるカプラシズマブが上市されました。VHH抗体の初の承認例ということで、今後の薬物動態が気になるところです。
国内企業の大正製薬においても、抗TNFα抗体オゾラリズマブを開発中です。2015年にAblynx社から開発権を導入し、Phase3の臨床試験を実施中です。期待が高まる一方で、抗TNFα抗体は既に上市されており(田辺三菱製薬のレミケード)、これに勝る効能を持つことが出来るかがポイントになってくるかと思います。
その他、メルクやノバルティスなどのメガファーマもVHH抗体の開発に参入していることから、注目度の高さが伺える一方で、多くがPhase IIIに達せずに開発中止となっていることも分かります。VHHに限らず、Phase IIIに到達して医薬品承認を受けることは非常に難しいことですが、開発中止となっている原因をしっかりと特定し、対策を講じていくことが今後のVHH開発に必要となるでしょう。私も動向を追っていきたいと感じています。
新型コロナウイルスに対するVHH抗体
日本での報告
2020年5月7日には、北里大学、Epsilon Molecular Engineering(EME)、花王が新型コロナウイルス(SARS-CoV-2)に対して感染抑制能(中和能)を有する VHH抗体の取得に成功したとの発表がありました(https://www.kitasato-u.ac.jp/jp/index.html)。プレスリリースの要点は以下の通りです。
- EMEが有するVHH抗体のスクリーニング技術(cDNAディスプレイ)の提供を受けて、花王にて新型コロナウイルスのスパイクタンパク質を標的に用いたスクリーニングを行い、候補となるVHH抗体を取得。
- 取得したVHH抗体を生産して標的分子への結合能を評価したところ、結合が見られた。
- 北里大学にて、新型コロナウイルスを用いて候補VHH抗体の感染抑制能を評価。取得したVHH抗体は新型コロナウイルスに結合するだけでなく、感染抑制能を有することが分かった。
抗体のスクリーニング技術って何?と感じた方は、こちらの記事も併せてご覧ください。
私が着目したのは、上記の3の項目です。ライブラリー法による抗体のスクリーニングにおいては、標的に結合するだけで薬効を持たない場合が多々あります。今回の共同研究で取得されたVHH抗体は、感染抑制能を有することから、診断薬のみならず医薬品としての応用を期待することができます。
スパイクタンパク質のうち、感染に寄与する領域を意図して狙うようにスクリーニングを行ったのか、偶然良いVHH抗体が取得できたのかは読み取れませんが、新型コロナウイルスの拡大から2-3か月でここまで評価できているスピード感は素晴らしいと感じます(もしも感染抑制を狙ってVHH抗体を取得しているなら、なお素晴らしい)。
海外での報告
その一方で、世界に目を向けると、5月5日のCell誌にて既に、VHH抗体の取得とメカニズム解析の論文が報告されています。
(https://www.sciencedirect.com/science/article/pii/S0092867420304943)
コロナウイルスのスパイクタンパク質を認識するVHH抗体を、ラマの免疫を利用して35日間で取得後、結晶解析及び感染メカニズムの考察までやっています。
論文は、発行される前に、科学的に正しいか評価する「査読」というプロセスがあります。5月5日に論文が発表された訳ですが、査読のために論文が受理されたのが、なんと3月25日です。一般に、動物免疫と、タンパク質の結晶解析は時間を要する実験であるにもかかわらず、これだけのスピード感を持って研究できているのを見ると、世界のトップラボはやはり一つレベルが違うなあと思います。
コロナウイルスのスパイクタンパク質を認識するVHH抗体の論文。凄いスピード感。ラマの免疫を利用して35日間でVHHを取得している訳だが、構造解析やメカニズムの考察までやっている。それでいて論文の受理日が3月25日。前からウイルス用意してた?ってレベルでバグってる笑https://t.co/N89fzfH2VO
— バイオニア@メーカー開発職の奮闘記 (@bioneer_chem) May 7, 2020
まとめ
今回は、VHH抗体の構造の特徴や開発状況について記載した後、新型コロナウイルスに対するVHH抗体の取得状況を、所感を交えて説明しました。VHH抗体の開発は発展段階にあり、体内動態に関する知見が今後集まり、抗体のドメインエンジニアリングによる新規薬剤開発につながっていくと思います。
私個人としては、VHH抗体は診断薬としての利用に適するのではないかと感じています。記事内に書いた通り、VHH抗体は構造安定性が高く、また、生産量が多く安価であるため、診断薬の検査素子としての重要要素をクリアしているためです。
日本の製薬企業やアカデミアでも、VHH抗体の研究は活発に行われていますので、今後も目を離さず動向を追っていきたいところです。
バイオ医薬品(抗体・ペプチド)の開発手法をご存知ですか? 進化工学は夢が詰まった分野なんです!
こんにちは、バイオニアです。
本日は、酵素や抗体を改変する手法である進化工学について紹介します。
2018年に、「免疫抑制の阻害による癌治療法の発見」で本庶佑教授がノーベル生理学・医学賞を受賞したことは有名ですが、実は同年のノーベル化学賞は、進化工学分野に授与されています。
2018年のノーベル賞は、まさに抗体医薬の年であったと言えると思います。
(受賞者のGregory P. Winter氏の講演を生で聞いたことがあるのは、私の数少ない自慢の一つです笑)
また、ここ数年世界一売れている薬である、抗TNFα抗体ヒュミラ(アダリムマブ)も、進化工学の代表的な手法の「ファージ提示法」により生み出されています。
本記事では、進化工学がなぜ強力な手法なのか、どのように発展しているのか、その一部でもお伝えできれば嬉しいです。
目次
進化工学とは
進化工学とは、酵素や抗体などの機能を有するタンパク質に対し、その機能や物性を改変する手法のことです。突然変異、淘汰、増殖といった自然界で偶発的に起こり得る生物の進化を試験管内で模倣することにより、短時間のうちに分子を進化させることが可能です。

この手法ではまず、遺伝子への変異導入によって、膨大な規模の変異体ライブラリーを作製し、目的の物性・機能を有するタンパク質が優先的に取得されるようなスクリーニング操作を行います。その後、取得した分子に変異導入を繰り返して配列を最適化することにより、目的機能を有するタンパク質を取得しています。
このように、分子の進化に方向性を持たせることにより、タンパク質が元来有する物性・機能を向上させるばかりでなく、天然には存在しない新規な物性・機能を有するタンパク質を取得することが可能となっています。
※医薬品開発の世界では、化合物群のことを「ライブラリー」と呼びます。
ライブラリーの規模、すなわち化合物群の多様性は、化合物探索において非常に重要となります。例えば、100個と1010個の化合物群から、目的の機能を持つ化合物を選定する場合を考えると、数が圧倒的に多い1010個の化合物群からの方が明らかに良いものが取れることが多いためです。そのため、製薬企業はこぞって、良い化合物が取得できる可能性の高い、良質なライブラリーの作製を目指して研究をしています。
ノーベル賞と進化工学
先述の通り2018年には、分子進化を制御して有用な酵素や抗体の開発に貢献した功績から、Frances H. Arnold、George P. Smith、Gregory P. Winterらがノーベル化学賞を受賞しました。
Frances H. Arnoldによる功績(酵素の進化)
Frances H. Arnoldは1993年に、ジメチルホルムアミド(DMF)中で作用する消化酵素subtilisinの活性の進化に指向性を持たせることに初めて成功しました。Arnoldは、subtilisinが乳タンパク質分解活性を有することに着目し、Error-prone PCRにより変異を加えた遺伝子を導入した枯草菌を乳タンパク質含有プレート上で生育させ、形成したハロの大きさからsubtilisinのスクリーニングを行いました。その結果、野生型の約256倍の分解活性を持つ変異型subtilisinの取得に成功し、分子の進化に方向性を持たせる「指向的進化工学」の可能性が示されたのです。
また、Arnoldは天然に存在する酵素では起こせない化学反応を、人工的に創出した酵素により行いました。種々の酸化反応の触媒として作用することが知られていたシトクロム酵素の活性中心に存在するアミノ酸残基を改変することで、有機化合物からシクロプロパンの合成や炭素-ケイ素結合の形成に成功しています。こうした天然には存在しない反応を酵素により実現できるという報告を皮切りに、各研究室や企業において、指向的進化工学を用いた酵素反応開発が進んでいます。

George P. Smithの功績(ファージ提示法の発明)
生命の機能性分子であるタンパク質(表現型)の情報は、DNA(遺伝型)が担っています。そのため、進化分子工学でタンパク質の機能を進化させるためには、遺伝型と表現型の対応付けが不可欠です。ウイルスを利用することで、これらの対応付けを達成しようと考えたのが、George P. Smithです。
George P. Smithは1985年に、繊維状ファージの感染能を保持しつつ、表層のpIIIタンパク質のN末端にランダムペプチドの提示が可能であることを報告しました。さらに1988年には、ビオチン化した抗体とランダムペプチド提示ファージを混合し、ストレプトアビジン固定化プレートを用いてこれらの複合体を回収・洗浄することで、抗体に結合可能なペプチド配列の同定を行いました。この手法はファージ提示法と呼ばれ、同一分子上で遺伝子(遺伝型)とタンパク質(表現型)を1対1で対応させることができる画期的な技術として、世界各国で今なお根強く使用されています。

ファージ提示法の具体的な流れは、下記の通りです。
①遺伝子へのランダムな変異導入により大規模なタンパク質変異体群をファージ表層に提示させ、抗原と反応させる。
②その後、非特異的に結合するファージを洗浄し、抗原に結合しているファージのみを溶出して回収し、大腸菌に感染させて増幅させる。
③増幅したファージを精製し、再びこの一連の操作を繰り返す。
④この過程で、抗原に結合するファージが濃縮していく。
⑤取得したファージをクローニングした後、遺伝子配列を解析することで、タンパク質のアミノ酸配列を同定することが出来る。
Gregory P. Winterの功績(ファージ提示法による抗体の創出)
George P. Smithの研究を受け、ファージ提示法を用いて抗体医薬品を開発したのがGregory P. Winterです。
Gregory P. Winterは1990年に、リゾチームを認識する一本鎖抗体(scFv: single chain Fragment variable)を提示させたファージと野生型のファージを混合したサンプルをリゾチームと反応させ、選択操作を繰り返すことで抗体提示ファージが濃縮されることを証明しました。この報告以前は、抗体を取得するために動物免疫を用いる手法が一般的でしたが、毒性のある抗原に対する抗体取得や完全ヒト抗体の作製が困難なことが制約となっていました。ファージ提示法は、これらの制約が無いことから普及し、抗体の親和性成熟は加速的に進むことになりました。
下図は、ファージ提示法による抗体分子の進化に関する論文数です。1990年のGregory P. Winterの研究を皮切りに、論文報告数が一気に加速していることが見て取れるかと思います。
その分野の広がり方が大まかに分かるので、論文数分析はお勧めです。

2002年には、ファージ提示法を基に創出された抗TNF-α抗体ヒュミラ(アダリムマブ)が関節リウマチの治療薬として承認され、その有用性が示されました。
さらにGregory P. Winterは、ペプチド医薬のフォーマットとして有望な二環(Bicyclic)ペプチドも開発しています。

完全に余談ですが、Gregory P. Winterは「ナイト」の称号を持っています。イギリスでは、勲章の授与に伴って王室から栄誉称号が授与されます。イギリス国民で「ナイト」に任じられた男性は Sir(サー)の敬称をつけて呼ばれることになるんです、凄いですね。尊敬します。
ファージ提示法以外の進化工学的手法
ファージ提示法のほかにも、遺伝型と表現型を1対1で対応させた提示システムが多数報告されています。これまでに、ウイルスや細胞、無細胞タンパク質発現系を用いた対応付けなどが報告され、広く利用されています。

細胞表層提示法
細胞表層提示法は、細菌や酵母の細胞表面にペプチドやタンパク質を提示させる手法です。代表的な酵母提示法では、細胞表面のAga2タンパク質やGPIアンカーに目的タンパク質を融合することで、一細胞あたり10000-100000分子を提示可能です。FACSを用いたスクリーニングが行われており、蛍光標識した標的分子に対する親和性成熟のみならず、連結・分解酵素等の高機能化にも適した提示系と言えます。
また、抗原結合性断片(Fab)などの大きな分子を提示可能な利点を持ちますが、形質転換効率の低さからライブラリー規模が小さい(~108)ことが欠点となっています。
無細胞系でのタンパク質提示法
無細胞系でのタンパク質提示法の中で最も代表的なリボソーム提示法では、タンパク質とそれをコードするmRNAを、リボソームを介して連結させます。無細胞系を用いることから形質転換の必要が無いため、1013程度の高いライブラリー規模を達成でき、断片化抗体や抗体様分子の親和性成熟が多数試みられています。
また、PCR産物を直接利用できることから、各システムの中で最も迅速な選択操作が可能であり、自動化も進んでいます。その一方で、提示可能な分子のサイズは一般的に小さく、技術を要することが欠点となっています。
東京大学の菅教授が立ち上げた企業、「ペプチドリーム」の根幹技術であるmRNA提示法も、この無細胞系でのタンパク質提示法の一種です。生物を扱わないことから、非天然アミノ酸の導入に適したシステムであるため、菅教授が開発した*フレキシザイムとうまくマッチしてあの夢の技術が生まれた訳ですね。
*フレキシザイム:特殊アミノ酸も含む任意のアミノ酸とtRNAを結合(アシル化)することができる人工のRNA触媒。
ペプチドリーム及びペプチド医薬については、過去記事を是非ご覧ください。
(菅教授の講演を生で聞いて直接質問させて頂いたことも、私の数少ない自慢の一つです笑)
その他の分子進化手法
その他にも、in vitro compartment(IVC)を用いた分子進化手法があります。これは、 IVC の内部で無細胞系によってタンパク質を合成し、その機能を指標に目的のタンパク 質を保有する IVC を選択する手法です。この手法では、タンパク質と遺伝子は物理的には連結していませんが、IVC内部で共局在させることにより対応付けを達成しています。酵素や膜タンパク質の進化に利用されています。
また、アプタマー(特定の分子と特異的に結合する核酸分子)の進化に使われる手法であるSystematic Evolution of Ligands by Exponential enrichment(SELEX)も、分子進化手法と捉えることが出来そうです。
アプタマーとDNAオリガミ技術を組み合わせ、がん細胞を兵糧攻めした論文を過去に紹介しています。よろしければ併せてどうぞ!
各提示システムの特徴
進化工学に用いられる各手法について、使用生物、形質転換の有無、化合物ライブラリーの規模、標的親和性(KD)、連結様式を下表にまとめました。

ファージ提示法とひとことで言っても、M13、T7、T4、lambdaといった種々のファージを使用した報告があります(最も良く使われるのはM13ファージ)。また、ライブラリーの規模は形質転換効率で左右されるため、ファージ提示法や細胞表層提示法のライブラリー規模が、無細胞系でのタンパク質提示法に比べて劣ることなども読み取れるかと思います。
基本的には、提示させたい分子や変異を導入したい残基数に応じてこれらのシステムを使い分けることになります。
まとめ
本記事では、進化工学の黎明期から昨今の傾向まで、幅広く紹介いたしました。DNAとタンパク質を対応付けることで、1013もの多様性がある化合物ライブラリーから、標的分子に対する親和性成熟や酵素の指向的進化が実現できる進化工学の強みを少しでも感じて頂ければ幸いです。
一方で、1013もの多様性をもってしても、実は10残基程度のアミノ酸配列しか網羅することができません。[ (アミノ酸20種)^10 ≒ 1013より。]
それでも、10残基程度のペプチド医薬であれば網羅的に探索できることから、高機能なペプチド分子の取得への期待が高まりますね。しかしながら、より残基数の多い抗体医薬の配列を100%網羅するためには、さらなるブレイクスルーが必要でしょう。考え方によっては、抗体医薬はまだまだ最適化の余地があるモダリティだ!とも言えますね。
最新研究では、AIの活用により、少しでも網羅的に配列を探索しようと試行しているようです。進化工学はまだまだ目の離せないアツい分野ですね。
ペプチド医薬品って最近聞くけど、結局どこまで来てるの??
こんにちは!バイオニアです。
今回は、ペプチド・抗体医薬の創出プロセス開発で修士号を取得した私が、ペプチド医薬品開発の現状について紹介します。
日本では、東京大学の菅教授が起業したペプチドリームが非常に有名ですが、世界に目を向けると、他にも有望なフォーマットやスクリーニング技術が数多くあります。しかしながら、これらの技術はあまり日本語でまとめられていないため、本記事で情報を整理していただければ嬉しいです。
目次
- ペプチド医薬品って?
- ペプチド医薬の上市状況
- 時代で見るペプチド医薬のフォーマット
- 人工環状ペプチドの創出例
- その他の環状ペプチドライブラリー作製とスクリーニング
- 化学修飾によるペプチド医薬の機能化
- まとめ
ペプチド医薬品って?
ペプチドは、二個以上のアミノ酸が脱水縮合して結合した短鎖の化合物です。近年、低分子医薬品と抗体医薬品の中間の特徴を有する「中分子医薬品」として着目されています。

新型コロナウイルスの医薬品開発の記事でも触れましたが、医薬品は、構成化合物の分子量によって、低分子医薬品と高分子医薬品に分類されてきました。
低分子医薬品は、標的への結合能が低く副作用が起こりやすい一方で、錠剤として口から飲むことが出来ます。標的分子が豊富に存在することも利点として挙げられます。
一方で高分子医薬品は、標的への結合性・特異性は高く(コストも高い)副作用が起きにくいが経口投与できないため、注射により投与されています。また、高分子であるが故に、(現在は)細胞内に入ることが出来ず、標的分子が限定されるという課題も有しています。
こうした中でペプチド医薬は、低分子医薬品と高分子医薬品の中間の分子量を持ち、高い親和性で細胞内外の標的分子を狙える新しいモダリティとして注目されています。
医薬分子としてのペプチドは、生物学的製剤と異なり、化学合成で製造可能であるため、製造コストの高いバイオ医薬品と比べて安価に原薬供給できることがメリットです。また、遺伝子工学技術の発展により、大規模ペプチド群から目的機能を持つペプチドを見出す探索技術が確立してきており、ペプチド医薬品は今後、アンメットメディカルニーズの充足に寄与すると期待されています。
ペプチド医薬の上市状況
2017年3月までに開発が試みられた484種のペプチド医薬のうち、68種が認可されています(ソース:Bioorg. Med. Chem. 26, 2700–2707 (2018))。さらに、155種のペプチドが開発途中にあり、そのうち100種を超えるペプチドが、治療の有効性評価を行うPhaseIIまで進んでいます(下図a)。また、1980年から2010年にかけて臨床試験に進んだペプチドの数は次第に増えており、2006年から2011年の5年間においては、年間平均22種ものペプチドが臨床試験に進みました(下図b, 黒線)。2010年以降に承認されたペプチド医薬を累積すると13種に上り(下図b, 灰色)、今後もペプチド医薬の市場は拡大すると予想されています。

時代で見るペプチド医薬のフォーマット
2000年までのペプチド医薬品開発では、天然由来のペプチド分子を基本骨格として、天然由来ペプチドをそのまま利用することや、安定性や薬効増強を狙った誘導体の設計と評価が主に行われました(下図)。この過程で、インシュリンやカルシトニンなどの天然型のホルモンペプチドや、誘導体としてのオクトレオチドなどが上市に至りました。一方で、2000年以降のペプチド医薬品開発では、進化分子工学的に取得された人工ペプチドが臨床研究に進む例が増えており、これらは主に環状化や機能性分子の付加を行ったペプチドです。

人工環状ペプチドの創出例
一般に環状ペプチドは、直鎖状のペプチドと比較して構造の自由度が低いため、エントロピー損失が低減でき、高い結合能を有します。また、構造を有することからプロテアーゼによる分解耐性を持ち、生体内での安定性が高いと言われています。進化工学に基づいて新規開発され、かつ臨床研究段階の環状ペプチドを下表に示しました。

環状ペプチド×PEG
3補体因子を阻害するAPL-2は、ジスルフィド結合により環状化したペプチドライブラリーを提示したファージ群より取得した13残基のペプチドを基に開発されました。APL-2は、ポリエチレングリコール(PEG)を修飾することで、体内での半減期を伸ばすように設計されており、臨床試験がphaseIIIまで進んでいます。
ライブラリーの考え方や、スクリーニングの方法については、こちらの記事を読めば理解が深まるかと思います。
二環(Bicyclic)ペプチド
膜型マトリックスメタロプロテアーゼ(MT1-MMP)を標的とするBT1718は、細胞毒素を修飾した二環(Bicyclic)ペプチドです。Bicyclicペプチドは、2018年のノーベル化学賞を受賞したGregory P. Winterにより開発されたフォーマットです。これは、配列内の3箇所にシステイン残基を設計したペプチド(CX6CX6C)を提示したファージライブラリーに対し、システイン残基と化学反応可能なブロモ基を3箇所持つトリス-ブロモメチルベンゼンを修飾することで作製されます。血液凝固活性化XII因子(FXIIa)を標的とした場合には、1.2 µMの阻害定数を示すペプチドを基に、より大規模なライブラリーからのスクリーニングと非天然アミノ酸の導入を行うことで、840 pMの阻害定数を示すBicyclicペプチドの取得にも成功しています。

特殊環状ペプチド
Millamoleculeは、免疫チェックポイントPD-L1を標的とする特殊環状ペプチドであり、ペプチドリーム社において開発が進んでいます。特殊ペプチドとは、生体内のタンパク質合成に使われる20種のL体のaアミノ酸だけでなく、非天然アミノ酸を含み、特殊骨格を持つペプチドをさします。東大の菅教授らは、多種多様なアミノ酸を任意のtRNA にアミノアシル化可能なフレキシザイムを用いて、特殊ペプチドを翻訳合成するためのFlexible In vitro Translation(FIT)システムを構築しました。さらに、それをmRNA提示法と組み合わせ、迅速に特殊ペプチドをスクリーニングするためのRandom non-standard Peptides Integrated Discovery(RaPID)システムを確立し、医薬標的に結合する特殊ペプチドの迅速探索システムを確立しています。

その他の環状ペプチドライブラリー作製とスクリーニング
上記した手法のほかにも、化学合成やインテインを基にした環状ペプチドライブラリーの作製手法が報告されています。下表に、現在研究が進んでいる環状ペプチドライブラリーの種類と構築技術をまとめました。また、これらの概略図を示します。
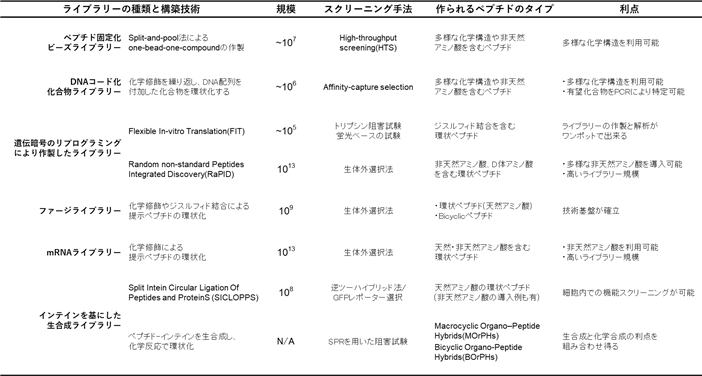

ペプチド固定化ビーズライブラリー
ペプチド固定化ビーズライブラリーは、スプリットプール法により合成したペプチドを化学修飾し、環状化することで作製されます(上図a)。スプリットプール法では、固相合成用のペプチドを結合させた担体を等分(スプリット)し、各々にそれぞれ異なるアミノ酸を結合させます。それらを一度混合(プール)した後、また等分してそれぞれに異なるアミノ酸を結合させます。これを数回繰り返すことにより、多様なペプチドを一度に合成することが可能です。
腫瘍壊死因子TNF-αや転写因子NFAT等の標的分子に対し、数µMの解離定数を示す環状ペプチドを取得した例があります。
DNAコード化化合物ライブラリー
DNAコード化化合物ライブラリー技術は、DNAタグを有する化合物ライブラリーを混合物のまま標的と反応させ、PCRによるDNAタグの増幅、配列解析を経て結合化合物を同定する手法です。これらの2つの手法では、多様な化学構造や非天然アミノ酸を含むペプチドを合成・スクリーニング可能ですが、ライブラリー規模が低い一面を持ちます(上図c)。
Split intein Circular Ligation Of Peptides and ProteinS(SICLOPPS)
SICLOPPSは、分裂型インテインタンパク質のスプライシング機構を用いた環状ペプチドライブラリーの作製手法です(上図f)。タンパク質間相互作用の有無を知ることが可能な、逆ツーハイブリッド法等の評価系を用いて、細胞内における機能スクリーニングが可能という利点を有しています。
Macrocyclic organo–peptide hybrids(MOrPHs)・Bicyclic Organo-peptide Hybrids(BOrPHs)
インテイン-ペプチドを生合成し、化学反応により環状化したMacrocyclic organo–peptide hybrids(MOrPHs)やBicyclic Organo-peptide Hybrids(BOrPHs)も報告されています(上図g)。p53-MDM2/MDMX間相互作用の阻害設計を試みた例があります。
化学修飾によるペプチド医薬の機能化
ペプチドの特性を変化させる手法の1つとして、化学修飾があります。化学修飾が施されたペプチドの割合は年々増加しており、2010年以降に臨床研究が始まったペプチドのうち、約30 %は化学修飾されたペプチドです。その中でも、抗体のFc断片の融合/修飾や、脂質・PEGの付加が大部分を占めています。

Fc断片や脂質、PEGの修飾は、体内での血中半減期を伸ばすために用いられ、RomiplostimやLiraglutideは医薬品として承認されました(下表)。また、ペプチドに対し、放射性物質や細胞毒性を有する低分子化合物の化学修飾も試みられており、医薬品開発に重要なツールとなっています。その他にも、細胞透過性の向上を目指した膜透過性ペプチドの付加などが試みられています。

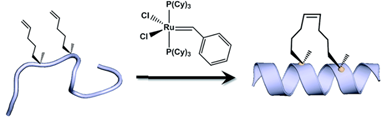
Stapledペプチド
腫瘍抑制因子p53の抑制因子であるMDM2とMDMXを阻害するALRN-6924は、炭化水素リンカーでペプチドを分子内架橋したStapledペプチドです。Stapledペプチドの合成には、ペプチド固相合成法が用いられます。α-メチル基(-CH3)とα-アルケニル基(-CnH2n-1)を含む2つのアミノ酸をペプチドに組み込み、これらのアミノ酸をオレフィンメタセシス等の化学反応により架橋しています。αヘリックス構造を安定化させることができ、細胞浸透性の向上効果が期待されています。
まとめ
今回は、注目されている割には体系化した記事が少ないペプチド医薬品についてまとめてきました。進化工学の発展により、10の13乗という膨大な規模の化合物群から、特定の機能を有するペプチドを同定可能なことが最大の強みと言えるでしょう。さらに、ライブラリーを一度作ってしまえばスクリーニングは自動で出来るため、迅速な化合物探索が可能であり、アンメットメディカルニーズへの取り組みが期待できます。
ペプチドの良いことばかり書いてきましたが、現段階では細胞内の標的を十分に狙えていないことや経口投与の実現性が低いことが課題として挙げられます。今後も目を離さず、動向を追っていきたいところです。
あなたは区別できる? 次世代DNAシーケンサーの分類
こんばんは!
今回は、DNAシーケンシング技術について紹介したいと思います。
昨今のバイオ業界では、次世代シーケンサー(NGS)というワードを無視できないほど研究が広がっていますが、「次世代」とひとことで言っても複数の分類があることはご存知でしょうか。ネットで調べても、日本語ではあまり整理されていないと感じたため、本記事がシーケンサーの分類、知識をつける一助になれば幸いです。
目次
- DNAシーケンサーの分類
- 第1世代のシーケンサー(サンガー法とキャピラリー電気泳動)
- 第2世代のシーケンサー(並列化自動逐次解析)
- 第3世代のシーケンサー(非光学検出/1分子検出)
- 第4世代のシーケンサー(ナノポアシーケンサー)
- まとめ
DNAシーケンサーの分類
DNAシーケンシングとは、DNAを構成するヌクレオチドの結合順序を決定することです。DNAは生物の遺伝情報を担う分子であるため、DNAシーケンシングは生化学実験の基本手段となっており、新しい方法が開発され続けています。
DNAシーケンサーの分類には何通りもの方法が存在しますが、以下の定義に従って4つに分類することが出来ます。
・第1世代: サンガー法及びキャピラリー電気泳動法(1975~2005年)
・第2世代: 並列化自動逐次解析(2005年~2009年)
・第3世代: 非光学検出/1分子検出(2010年~2014年)
・第4世代: ナノポアシーケンサー(2014年~)

第1世代のシーケンサー(サンガー法とキャピラリー電気泳動)
第1世代では、サンガー法とキャピラリー電気泳動を用いたDNAシーケンシングが行われてきました。
サンガー法では、DNAポリメラーゼによる塩基伸長反応を利用します。この際、伸長に必要な3’の水酸基を化学的にブロックした構造変異体を混合して反応に使用することで、ランダムに伸長停止したDNA断片を調製します。その後、長さの異なるこれらのDNA断片を電気泳動で分離することで、配列を同定可能です。

サンガー法で配列を同定するためには、解析サンプル量を十分に確保する必要性から、DNA配列の単離・増幅が必要となります。そのため、大量のDNA配列の解読には、時間とコストを要することが課題です。こうした背景から、第2世代以降のDNAシーケンサー開発が進みました。
その一方で、網羅的解析が必要ない配列解析のために、未だにキャピラリー電気泳動による配列決定は重宝されており、研究室で使用したことがある方も多いのではないでしょうか。
サンガー法の功績は、なんといっても「ヒトゲノム計画」でしょう。ヒトのすべてのDNAを解読しようというこの試みは、1990年代に開始してから13年間にもわたり、世界中の科学者が力を合わせて、ヒトゲノムに含まれる30億個の塩基対全てを解読したのです。
第2世代のシーケンサー(並列化自動逐次解析)
第2世代シーケンサーの特徴は、第1世代と比較して「大量高速処理を安価」に実施できることであり、一般に第2世代以降のDNAシーケンサーを「次世代シーケンサー」と呼んでいます。大量処理は、並列度の向上と自動化により達成されており、解析量当たりのコストも第1世代と比較して1/100以下へ削減されました。
大量高速処理にあたり、第1世代ではクローン化により増幅していた前処理プロセスが、多数のクラスターによる増幅へと改良されました。また、塩基認識プロセスにおいても、クラスターごとの酵素反応、試薬付加、洗浄を並列かつ逐次的に、自動で実施できる仕組みが開発されました。
第2世代シーケンサーを開発した企業によって、プラットホームに差異はありますが、「塩基ごとに光学系装置で取得した多量の画像を情報処理したうえで塩基同定する」という点で、原理的には共通しています。

第2世代シーケンサーとしては主に、核酸取り込み時のピロリン酸放出を検出するPyro-sequencing法を利用した454GS FLX(Roche社)や、1塩基合成技術(Sequencing by Synthesis)に基づくMiseq, Hiseq(Illumina社)があります。また、リガーゼを用いたオリゴDNAのライゲーションに基づくSequencing by Hybridization法を利用したSOLiD(Life Technologies社)も開発されています。
この中でも、特に普及したのがillumina社のシーケンサーです。本手法は、1.前処理 2.塩基認識 3.検出同定の3ステップに分けられます。

始めに、前処理過程でブリッジPCRと呼ばれる増幅法を用いて、1種類のDNA断片から成るクラスターを多数生成します。まず、数百塩基の長さのDNA断片の両端に、PCRによって2種類のアダプターを付加し、精製します。次に、アダプターに相補的な塩基配列が共有結合されているフローセル(スライドガラス)にDNA断片を固定し、ブリッジ構造を形成させます。この状態でPCRを繰り返すことで、同一DNA断片から成るクラスターが形成され、フローセル上での多種類クラスターの調並列解析が可能となります。
次に、クラスターごとに同時並行で、4種類の蛍光物質で標識された塩基を1塩基ずつ加え、ポリメラーゼ伸長反応を行います。各塩基は保護基で修飾されており、1塩基合成で反応が止まります。この際に、各クラスターの蛍光を画像で捕捉し、次いで保護基と蛍光標識を外し、次の反応へと進みます。本原理では、保護・脱保護の機構により、4種類の均等な蛍光修飾塩基を1塩基ずつ確実に読み取ることができ、高精度な解析が可能となります。
第3世代のシーケンサー(非光学検出/1分子検出)
更なるコスト低減、高スループット、簡便化を目指した第3世代シーケンサーの開発方向性は、2つに大別されます。
1つ目は、第2世代シーケンサーで採用されている光学系以外の検出法の採用です。特に、電気化学的な方法を用いた検出法では、高価な蛍光試薬及び光学系検出装置を使用せず、装置及び解析コストの低減が期待できます。例として、半導体チップによるプロトン測定法を利用したIon PGM, Ion Proton(Life Technologies社)があります。
もう一つの開発方向性として、PCR増幅等の前処理を必要としない原理の採用があります。「1分子シーケンシング」は、多数の分子の平均値を計測するのではなく、DNA一分子を鋳型として1塩基ごとに反応を検出・同定する方法であり、各種スペックの向上のみならず、一般的に増幅によって失われる塩基修飾解析を可能とすることが期待されます。例として、1分子リアルタイム法に基づくRS(Pacific BioScience社)が挙げられます。
第4世代のシーケンサー(ナノポアシーケンサー)
ナノポアシーケンシングとは、DNA一分子だけが通過できる構造(ポア)を塩基認識プロセスに活用し、主に電気的に同定検出する新たな原理のシーケンサーです。1分子解析のためPCRなどの前処理が不要であり、また、蛍光試薬や検出装置が必要ない利点を有しています。タンパク質ナノポア法によるMinION(Oxford Nanopore Technologies社)がその一例です。

これまでのシーケンサーよりも長鎖のDNA(数十キロ~数百キロ塩基)解析が可能で、これまで解析が行われていない生物の新規ゲノム解析や、従来型の次世代シーケンサーでは解析が困難な特殊なゲノムの遺伝子解析への利用が期待されています。
初期投資をほとんど必要とせず、また、手のひらに持ち運ぶことが可能なシーケンサーであり、医療現場での利用に期待が広がります。
これまでDNAシーケンサー技術では、日本は後れを取ってきましたが、大阪大学発のベンチャー企業であるQuantum Biosystemも、第4世代のシーケンサーを開発しています。タンパク質ナノポアではなく、シリコン基板などの固相構造を採用する手法となっており、2021年に試作機の提供を開始する計画です。
素晴らしい技術を持つスタートアップ企業であり、もし私にお金があれば今すぐ出資したいと感じる程です笑
まとめ
第1世代~第4世代までのDNAシーケンサーについて記しましたが、結局のところ、リード数やリード長、スループット性を考慮してシーケンサーを選ぶ必要があります。下表を参考に、目的に応じたシーケンサーを調査することから初めてみてはいかがでしょうか。

DNAナノロボットでがん細胞を兵糧攻めする
こんばんは!
本日は、DNAをベースとするナノロボットの利用より、がん細胞を狙って兵糧攻めすることに成功した論文を紹介します。
2018年に、Nature Biotechnology誌に掲載された論文です。
(Nature Biotechnology volume36, pages258–264 (2018) Suping Li et. al, https://www.nature.com/articles/nbt.4071)
がんの現状と治療法について簡単に記した後、論文紹介に入りますので、詳しい方は「本論文のコンセプト」まで飛ばしてください。
目次
がんと日本人
がんとは、正常な細胞の遺伝子が変化し、その変化した遺伝子の働きによって細胞が異常に増殖を始めた結果、起こる病気です。たった1個の細胞が変化して増殖を重ねた結果として腫瘍ができ、この腫瘍の悪性化が進むことで、臓器の機能が衰えてしまいます。さらに、がん細胞は飛び火してほかの臓器も侵します。
論文の内容を説明する前に、がんに関する統計データを簡単に紹介します。

日本において、がんで亡くなる方の人数は年々増え続けており、その数は年間約37万人にも上っています。死因別で考えると全体の約27.4%であり、日本人の3-4人に1人ががんで死亡しています。1981年以来、日本人の死因のトップの座にあり続けています(2位は心臓病、3位は老衰・脳卒中)。

主ながん治療法
がんの告知を受けた方に示される治療方法は、「化学療法」「手術療法」「放射線療法」の3つに大別され、これらを三大療法と呼んでいます。検査結果に加えて、患者の年齢や性別、希望などを考慮して総合的に判断し、治療方法が提案されています。2つ以上の治療を組み合わせる「集学的治療」が行われることもあります。

化学(薬物)療法
主に、抗がん剤によってがん細胞の死滅や増殖抑制を狙う治療方法です。投与方法は点滴や注射、内服であり、血液を通して全身を巡るため、小さな転移にも効果があります。一方、脱毛や倦怠感といった副作用や、肝臓や腎臓などへの障害が避けられないことが課題です。これを克服するため、がん細胞だけに作用する分子標的薬の開発が進んでいます。2018年のノーベル生理学・医学賞を受賞した本庶佑教授のオブジーボも、免疫チェックポイントを狙う分子標的薬です。
(本記事で紹介するDNAナノロボットも、がん細胞のみを狙って副作用を無くそうというデザインとなっています。)
手術療法
がんの病巣や、周囲組織に転移したがんを切除する療法です。がんの塊を一気に除去可能なことと、転移が無ければ完治の可能性が高いことがメリットです。一方、体にメスを入れるため、患者の体力が必要なことや、傷の治癒に時間がかかることが課題です。この課題に対し、近年では切除範囲を最小に留めたり、内視鏡を使った手術など、体への負担を少なくする手術が普及しつつあります(低侵襲治療と言います)。
放射線療法
がんの病巣部に放射線を照射し、がん細胞を死滅させる局所療法です。治療前の検査技術や放射線の照射方法の進歩に伴って、がんの大きさや位置を正確に測れるようになっており、効果は向上しています。照射部分に放射線障害が現れることや、めまいなどの全身症状が現れる場合があることが課題です。
本論文のコンセプト
狙いは血管新生の阻害
血管新生とは、新しい血管を形成することです。体内において、血管内皮細胞増殖因子(VEGF)などの化学シグナルによって制御されますが、通常は血管新生の促進効果と阻害効果のバランスが保たれているため、成長や治癒が必要な場所でのみ血管が形成されています。
一方、がん細胞においては、腫瘍が一定の大きさに成長するために血液の供給が必要なことから、血管新生が多く見られる特徴があります。新しい血管が成長中の腫瘍に酸素と栄養を与えることで腫瘍が増大し、がん細胞が近くの組織や血管へ侵入することで転移が起こっているのです。
こうした背景から、がんが必要とする血液供給を不足させることで増殖を抑える薬剤の開発が進んでいます。

血管新生阻害分子の利用
本論文では、がん細胞での血管新生を阻害するために、血液の凝固に関与する酵素である「トロンビン」に着目しました。この酵素は、フィブリノーゲンと呼ばれる水溶性の線維素原に作用し、非水溶性のフィブリンに変える機能を持ちます。こうしてできたフィブリンは、血小板と協力して血栓を形成することが出来ます。(ヒトがケガした時にもこうしたメカニズムで止血が行われています)
そこで著者らは、がん細胞にのみトロンビンを届け、血栓を形成させて血管新生を阻害することで、がん治療を実現しようと考えたのです。

キャリアとして選ばれたのはDNAオリガミ
がん細胞でない部位でトロンビンが放出されてしまった場合、血栓を形成して予期せぬ副作用が生じ得ます。そこで、安全にトロンビンを体内で運ぶ手段として、「DNAオリガミ技術」に着目しました。
DNAオリガミ技術とは、DNAを用いてナノ構造体を形成する手法のことです。近年、DNAは遺伝情報の伝達のみならず、「材料」としての応用も試みられており、下図のようなニコちゃんマークや立体的な構造を形成できるまでに至っています。また、任意の外部シグナルに応じて構造を変えることも可能となっており、体内で薬剤を運ぶ箱(DDSキャリア)としての利用が期待されています。

以上をまとめると、本論文では、DNAをベースとしたナノロボットに血管新生を阻害するトロンビンを搭載することで、がん細胞を兵糧攻めする化学療法を開発しました。
本論文で用いたDNAナノロボットの設計・作用を下図に示します。
1. DNAオリガミシート(60×90 nm)上に、トロンビンを搭載する
2. シートを開閉させるよう設計したファスナーDNAと、がんを認識するDNAアプタマーを取り付ける(シートはClose状態となり、円筒状になる。)
3. 体内に投与された後、がんの血管内皮細胞表面で発現する分子(ヌクレオリン)をDNAアプタマーが認識する
4. 認識によりシートがOpen状態になり、トロンビンが露出される
5. 血栓が形成され、がん細胞が壊死する

トロンビンの固定化と活性評価
まず、設計通りにナノロボットが形成されたかどうかをTEM画像から評価しました。その結果、Close状態・Open状態となったDNAナノロボットが観察され、また、約4分子のトロンビンをDNAシート状に固定化できることが分かりました。
さらに、固定化されたトロンビンが活性を維持しているかを、Chromozym THというトロンビンの基質を用いて評価したところ、未固定のトロンビン+DNA(グラフ青)と比較してトロンビン-DNA複合体(グラフ赤)でも活性が落ちていないことが分かりました。

ファスナー機能と標的応答性の評価
次に、Close状態のDNAナノロボットが、がん細胞に発現するヌクレオリンを認識してOpen状態に変化できるかを評価しました。蛍光分子と消光分子を利用して、これらの分子が近いClose状態では蛍光を発しないように、分子の距離が離れたOpen状態では蛍光が発するようにデザインして評価したところ、ヌクレオリンを提示したがん細胞の存在下においてのみ、ファスナーが開くことが分かりました。
さらに、血小板の凝集時間を測定したところ、血管内皮細胞の存在下でのみ、Close状態のDNAナノロボットがOpen状態となり、血小板の凝集促進、すなわちがん細胞への兵糧攻めが実現していることが分かりました。

マウス生体内での機能評価
最後に、DNAナノロボットが生体内で機能を有するかをマウス実験により評価しました。脇腹に悪性腫瘍を持つマウスに、①トロンビン搭載ロボット ②トロンビン未搭載の空ロボット ③トロンビン ④生理食塩水 を3日ごとに投与し、腫瘍のサイズを測定しました。その結果、トロンビンを搭載したナノロボット(グラフ黒)を投与した場合には、がん腫瘍の肥大化を有意に防ぐことに成功しており、なんと8匹のうち3匹はがんを完治することが出来ました。

まとめ
DNAオリガミの技術も、いよいよここまで来たかという論文でした。標的分子が存在する場合のみ、ファスナーDNAが開閉する設計は非常に面白いですね。分子標的薬などと比較して、効果・コスト面で優位に立つことは果たして可能なのか、今後の展望が気になるところです。
人生100年時代の昨今においては、健康寿命を延ばすことが重要です。がんを早期に発見する技術及び、低負荷で受けられるような医療の実現に向けて、既存の技術がつながってより高次なものになるのを見るのは面白いものです。
以上、ご覧いただきありがとうございました。
【多面的に見る】新型コロナ治療薬の開発状況(4/21現在)
こんばんは!
本日は、新型コロナ治療薬の開発状況に興味を持ち、調査したので記事にします。
連日、「世界中で新しい治療薬が開発されている」とか、「アビガンやレムデシビルという薬が効くらしい」とのニュースが流れていますが、横文字ばかりで正直覚えられないですよね(笑)。そんな方にも分かりやすいように、色々な薬がある中で注目すべき項目をピックアップし、表にまとめてみました。(20/4/21作成)。
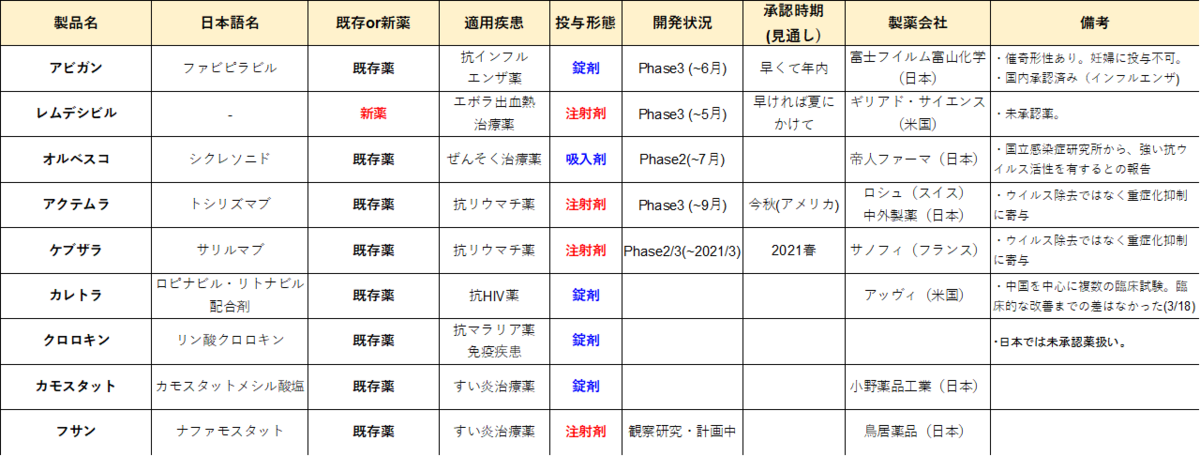
◆表から読み取れる大事なポイント
1. 新型の感染症への対応は既存薬メインとなる
調査しきれていない分も当然あると思いますが、開発中の主な治療薬のほとんどが既存薬です。唯一「新薬」と表記したレムデシビルも、もともとはエボラ出血熱の治療薬として開発され、有効性の低さから中断された薬です。
ここで、既存薬を応用しているのは、有効性が確認されればすぐに医療現場で使用できるためです。新薬をゼロから開発して実用化するためには、10~20年の時間が必要となってしまう一方で、既存薬では安全性確認等の時間がかかる作業が終わっているため、短期間で使用できる可能性があるのです(この考え方を「ドラックリポジショニング」と呼びます)。
レムデシビルは、重症患者の回復につながったとの報告から注目されていますが、これまでに認可・承認されておらず、その安全性や有効性が未確立なことが大きなネックと言えるでしょう。
2. 錠剤か注射剤か
医薬品は、構成化合物の分子量によって、低分子医薬品と高分子医薬品に分類されます。(正確には近年、中分子のペプチドも注目されていますが、ここでは割愛)
低分子医薬品は、標的への結合能が低く副作用が起こりやすい一方で、錠剤として口から飲むことが出来ます。
一方で高分子医薬品は、標的への結合性・特異性は高く(値段も高い)副作用が起きにくいが経口投与できないため、注射により投与されています。
このように、医薬品のフォーマットは一長一短であり、症状に応じての使い分けが必要となりますが、経口投与できる錠剤には大きな役割があると私は考えています。考え方は非常にシンプルで、高分子医薬品での治療では病院での注射がマストとなるからです。医療関係者の感染が続々と報告される現状において、病院に多くの患者さんを集め、皆に抗体医薬をはじめとする高分子医薬品を投与するのは非現実的です。高分子医薬品の利用は、重篤な患者を対象とすることになると思います。
以上より、投与の簡便性からは、アビガンやシクレソニドといった薬は有望ですが、危険性・効果を相談・調査して正しく把握することが大切です。例えばアビガンには、催奇形性があるため妊婦に投与不可という課題があります(男性の精液中に移行するとの報告も)。
3. 開発状況
①にて、既存薬であれば実用化にあまり時間がかからないと書きましたが、それでも数カ月~数年の時間を要してしまいます。
【アビガン】
アビガンは、富士フイルム富山化学が開発した抗インフルエンザ薬であり、国内承認済みです。重篤ではない肺炎を合併した新型コロナ感染症の患者を対象とする、第3相臨床試験を6月末までに実施するようです。日本には、医薬品の審査スピードを速める「先駆け審査指定制度」がありますが、最速でも6か月程度が必要となることを考えると、法整備なしでは早くて年内の適用となるでしょう。頑張れ日本政府!
【レムデシビル】
レムデシビルは、コロナウイルスを含む一本鎖RNAウイルスに対し、複製阻害作用を持ちます。日本を含む世界各国で第3相臨床試験を実施中であり、日本では4月14日から患者への投与が始まっています。5月までに重症・中等症患者対象の試験結果が得られる予定です。
【シクレソニド】
シクレソニドは、帝人ファーマが開発した吸入ステロイド薬です。国立感染症研究所から、強い抗ウイルス活性を有することが示されています。実際の患者に投与され、良好な経過を得たとの報告例があります。第2相臨床試験が始まっており、7月頃には結果が出てきそうです(https://clinicaltrials.gov/ct2/show/NCT04330586)
【アクテムラ・ケブザラ】
新型コロナ特有の症状が、重症の肺炎です。その肺炎重症化を抑制する効果があるとされるのがリウマチ治療薬で、中外製薬のアクテムラやサノフィのケブザラがあります。アクテムラは4月から治験を開始し、米国で今秋の承認を目指して動いているようです。
まとめ: 医薬品の普及はまだ先。予防を徹底しよう。
3つの観点から新型コロナウイルスの医薬品開発状況を見ましたが、既存薬を転用してもなお医薬品の普及には時間がかかります。
手洗いうがいを徹底する、咳エチケットを守る、三密を防ぐことなどを愚直に守り、自分だけでなく周囲の人間も守っていきましょう。
ゴールデンウィークに外出できないのは寂しいですが、今は勉強して自分を高めたり、時間が必要な趣味に没頭してみてはいかがでしょうか。
*新型コロナウイルスの情報は、山中伸弥教授のHP(https://www.covid19-yamanaka.com/)で非常に分かりやすく説明されています。コロナウイルスを「正しく」恐れましょう。
◆参考にしたサイト
・AnswersNews 「新型コロナウイルス 治療薬・ワクチンの開発動向まとめ【COVID-19】(4月17日UPDATE)」https://answers.ten-navi.com/pharmanews/17853/
・日経新聞「新型コロナ治療薬 開発急ピッチ」
https://www.nikkei.com/article/DGKKZO58240640Y0A410C2MM8000/
コーヒーを飲んで糖尿病をコントロール ~ヒトはポパイになれるのか~

おはようございます!
コーヒー大好きバイオニアです。
本日は、「コーヒーのカフェインをトリガーにして糖尿病をコントロールする」という、一風変わったアプローチで病気と付き合う方法を提案した論文を紹介します。
2018年に、Nature Communications誌に掲載された論文です。
(Nature Communications vol. 9, 2318 (2018) Daniel Bojar et. al, https://www.nature.com/articles/s41467-018-04744-1)
本論文のコンセプトは、以下の通り。
毒性が無く安価に製造可能なカフェインを利用し、遺伝子の転写を制御
⇒糖尿病治療に有用なホルモン(インスリン)の体内生産を促進
⇒カフェインを摂取するだけで自分で糖尿病を制御する
目次
遺伝子って? どのように応用されてきたの?
遺伝子とは、生物の体をつくる設計図に相当するものです。ヒトには約2-3万個の遺伝子があると考えられています(未だに確定していない)。
私たちの体の中で、遺伝子の発現は、外部環境や細胞内の環境変化により制御されているのですが、これを人工的にコントロールして役に立てようという試みが昔からあります。
例えば、研究用途や医療に使用されるタンパク質の生産です。
タンパク質の生産には、大腸菌が広く用いられています。
その理由は、大腸菌に外部から遺伝子を導入すると、「これは自分の遺伝子だな」と勘違いして遺伝子を複製してくれるためです。
しかしながら、その遺伝子からタンパク質を大量に生産してもらうためには、ひと工夫が必要です。よく使われるのがpETシステムというもので、簡単に説明すると、pETプラスミドと呼ばれる遺伝子を持つ大腸菌に、IPTGという化合物を加えると、タンパク質を大量に作るためのスイッチをONにすることができます。
つまり、「何らかのインプットを加えることで遺伝子のスイッチをONにし、有用なアウトプットを得る」ということが可能です。
ポパイがほうれん草(インプット)を食べると、ポパイの体の中で何らかのスイッチが入り、パワーアップ(アウトプット)して悪者のブルートをやっつけることが出来るのと同じことです。
既に、人工の遺伝子回路を動物へ応用することが試みられており、「青色の光をマウスに当てることでマウスのEDを治療する」といった研究も報告されています(いつかこちらも紹介できればと思います)。

本研究で構築した人工遺伝子回路
本研究では、毒性が無く、安価に製造可能なカフェインを摂取する(インプット)ことで遺伝子回路をONにし、インスリン生産を促進する(アウトプット)ことで糖尿病を制御することを目指しました。
著者らは、カフェインに結合する抗体(aCaffVHH)を使用することを考えました。着目したこの抗体は、カフェインを介して二量体化する性質を持っていました。そのため、以下の流れでインスリン生産を促進する人工遺伝子回路を構築しました。
1. カフェインを認識してaCaffVHHが二量体化
2. aCaffVHHに融合したタンパク質がJAK/STATシグナルを伝達
3. STAT3(転写活性化因子)がインスリンの分泌を促進する遺伝子の転写を誘導
4. インスリンを生産

構築した細胞がカフェインに応答するかの評価
まず、先述した遺伝子回路の実現に必要な2種のプラスミド遺伝子をHEK293T細胞に導入し、C-STARという細胞株を作ります。その後、カフェイン濃度を振って細胞に添加し、発現したタンパク質を定量しました。
その結果、カフェインの濃度依存でタンパク質の発現量が変化しており、カフェインへの応答性を有する細胞を構築出来ていることが分かりました(下図左グラフ)。
また、カフェインと水を交互に添加したところ、カフェインを加えてタンパク質を分泌させた後でも、水を加えることで分泌量が減るという、可逆性を持つことが分かりました(下図右グラフ)。カフェインを摂取したらずっとアウトプットを出すわけではなく、水を飲めば止められるという訳です。

本システムの特異性評価
次に、カフェインに類似した化合物を加えてもタンパク質が分泌されないかの評価を行いました。似た化合物が体内に入ったときに、インスリンが分泌されては困るためですね。
カフェインに加えて、下図のような3種類の構造類縁体を細胞に添加し、発現タンパク質を定量したところ、構造類縁体では濃度を振ってもタンパク質の分泌はほとんど見られず、今回構築した遺伝子回路には特異性があることが分かりました。

本システムを用いた糖尿病治療
最後に、インスリンの分泌を促進するGLP-1ホルモンをコードした細胞株を構築し、細胞が入った浸透性カプセルを糖尿病マウスに埋め込みました。その後、マウスの口から市販のNespressoを飲ませ、血中のGLP-1ホルモンを定量しました。
その結果、市販のコーヒーに含まれるカフェイン量を口から摂取するだけでも問題なくシステムが作動しており、1週間後には糖尿病でないマウスと同程度のGLP-1ホルモンを分泌出来ることが分かりました。

まとめ
本論文では、市販飲料が含むカフェインでも遺伝子の転写を促進するシステムを構築でき、ホルモン量の制御により糖尿病マウスを治療することが出来ました。ヒトにすぐに応用できるかと言われるとそうではないと思いますが、コーヒーを飲むだけで糖尿病を始めとする病気と向き合うことが出来るような世の中がいつか来たら面白いと思い、紹介させていただきました。
また、本システムは、使い方次第では依存症のような症状を防ぐこともできるのではないかと考えています。ニコチンやヘロインを認識するVHHを作り、これらの中毒者に細胞を投与します。もしも中毒者が欲求に負け、ニコチンやヘロインを摂取した場合には、何か不快に感じるようなアウトプットを放出するように設計すれば良いと考えるためです。
しかし、ネスプレッソで病気を治そうと考えるなんて、発想力がすごいなぁ…笑