ペプチド医薬品って最近聞くけど、結局どこまで来てるの??
こんにちは!バイオニアです。
今回は、ペプチド・抗体医薬の創出プロセス開発で修士号を取得した私が、ペプチド医薬品開発の現状について紹介します。
日本では、東京大学の菅教授が起業したペプチドリームが非常に有名ですが、世界に目を向けると、他にも有望なフォーマットやスクリーニング技術が数多くあります。しかしながら、これらの技術はあまり日本語でまとめられていないため、本記事で情報を整理していただければ嬉しいです。
目次
- ペプチド医薬品って?
- ペプチド医薬の上市状況
- 時代で見るペプチド医薬のフォーマット
- 人工環状ペプチドの創出例
- その他の環状ペプチドライブラリー作製とスクリーニング
- 化学修飾によるペプチド医薬の機能化
- まとめ
ペプチド医薬品って?
ペプチドは、二個以上のアミノ酸が脱水縮合して結合した短鎖の化合物です。近年、低分子医薬品と抗体医薬品の中間の特徴を有する「中分子医薬品」として着目されています。

新型コロナウイルスの医薬品開発の記事でも触れましたが、医薬品は、構成化合物の分子量によって、低分子医薬品と高分子医薬品に分類されてきました。
低分子医薬品は、標的への結合能が低く副作用が起こりやすい一方で、錠剤として口から飲むことが出来ます。標的分子が豊富に存在することも利点として挙げられます。
一方で高分子医薬品は、標的への結合性・特異性は高く(コストも高い)副作用が起きにくいが経口投与できないため、注射により投与されています。また、高分子であるが故に、(現在は)細胞内に入ることが出来ず、標的分子が限定されるという課題も有しています。
こうした中でペプチド医薬は、低分子医薬品と高分子医薬品の中間の分子量を持ち、高い親和性で細胞内外の標的分子を狙える新しいモダリティとして注目されています。
医薬分子としてのペプチドは、生物学的製剤と異なり、化学合成で製造可能であるため、製造コストの高いバイオ医薬品と比べて安価に原薬供給できることがメリットです。また、遺伝子工学技術の発展により、大規模ペプチド群から目的機能を持つペプチドを見出す探索技術が確立してきており、ペプチド医薬品は今後、アンメットメディカルニーズの充足に寄与すると期待されています。
ペプチド医薬の上市状況
2017年3月までに開発が試みられた484種のペプチド医薬のうち、68種が認可されています(ソース:Bioorg. Med. Chem. 26, 2700–2707 (2018))。さらに、155種のペプチドが開発途中にあり、そのうち100種を超えるペプチドが、治療の有効性評価を行うPhaseIIまで進んでいます(下図a)。また、1980年から2010年にかけて臨床試験に進んだペプチドの数は次第に増えており、2006年から2011年の5年間においては、年間平均22種ものペプチドが臨床試験に進みました(下図b, 黒線)。2010年以降に承認されたペプチド医薬を累積すると13種に上り(下図b, 灰色)、今後もペプチド医薬の市場は拡大すると予想されています。

時代で見るペプチド医薬のフォーマット
2000年までのペプチド医薬品開発では、天然由来のペプチド分子を基本骨格として、天然由来ペプチドをそのまま利用することや、安定性や薬効増強を狙った誘導体の設計と評価が主に行われました(下図)。この過程で、インシュリンやカルシトニンなどの天然型のホルモンペプチドや、誘導体としてのオクトレオチドなどが上市に至りました。一方で、2000年以降のペプチド医薬品開発では、進化分子工学的に取得された人工ペプチドが臨床研究に進む例が増えており、これらは主に環状化や機能性分子の付加を行ったペプチドです。

人工環状ペプチドの創出例
一般に環状ペプチドは、直鎖状のペプチドと比較して構造の自由度が低いため、エントロピー損失が低減でき、高い結合能を有します。また、構造を有することからプロテアーゼによる分解耐性を持ち、生体内での安定性が高いと言われています。進化工学に基づいて新規開発され、かつ臨床研究段階の環状ペプチドを下表に示しました。

環状ペプチド×PEG
3補体因子を阻害するAPL-2は、ジスルフィド結合により環状化したペプチドライブラリーを提示したファージ群より取得した13残基のペプチドを基に開発されました。APL-2は、ポリエチレングリコール(PEG)を修飾することで、体内での半減期を伸ばすように設計されており、臨床試験がphaseIIIまで進んでいます。
ライブラリーの考え方や、スクリーニングの方法については、こちらの記事を読めば理解が深まるかと思います。
二環(Bicyclic)ペプチド
膜型マトリックスメタロプロテアーゼ(MT1-MMP)を標的とするBT1718は、細胞毒素を修飾した二環(Bicyclic)ペプチドです。Bicyclicペプチドは、2018年のノーベル化学賞を受賞したGregory P. Winterにより開発されたフォーマットです。これは、配列内の3箇所にシステイン残基を設計したペプチド(CX6CX6C)を提示したファージライブラリーに対し、システイン残基と化学反応可能なブロモ基を3箇所持つトリス-ブロモメチルベンゼンを修飾することで作製されます。血液凝固活性化XII因子(FXIIa)を標的とした場合には、1.2 µMの阻害定数を示すペプチドを基に、より大規模なライブラリーからのスクリーニングと非天然アミノ酸の導入を行うことで、840 pMの阻害定数を示すBicyclicペプチドの取得にも成功しています。

特殊環状ペプチド
Millamoleculeは、免疫チェックポイントPD-L1を標的とする特殊環状ペプチドであり、ペプチドリーム社において開発が進んでいます。特殊ペプチドとは、生体内のタンパク質合成に使われる20種のL体のaアミノ酸だけでなく、非天然アミノ酸を含み、特殊骨格を持つペプチドをさします。東大の菅教授らは、多種多様なアミノ酸を任意のtRNA にアミノアシル化可能なフレキシザイムを用いて、特殊ペプチドを翻訳合成するためのFlexible In vitro Translation(FIT)システムを構築しました。さらに、それをmRNA提示法と組み合わせ、迅速に特殊ペプチドをスクリーニングするためのRandom non-standard Peptides Integrated Discovery(RaPID)システムを確立し、医薬標的に結合する特殊ペプチドの迅速探索システムを確立しています。

その他の環状ペプチドライブラリー作製とスクリーニング
上記した手法のほかにも、化学合成やインテインを基にした環状ペプチドライブラリーの作製手法が報告されています。下表に、現在研究が進んでいる環状ペプチドライブラリーの種類と構築技術をまとめました。また、これらの概略図を示します。
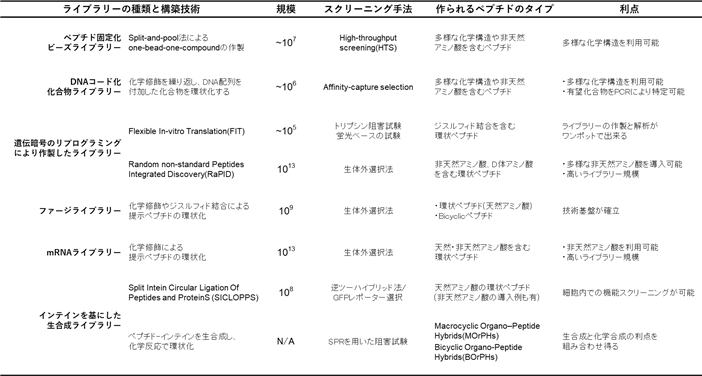

ペプチド固定化ビーズライブラリー
ペプチド固定化ビーズライブラリーは、スプリットプール法により合成したペプチドを化学修飾し、環状化することで作製されます(上図a)。スプリットプール法では、固相合成用のペプチドを結合させた担体を等分(スプリット)し、各々にそれぞれ異なるアミノ酸を結合させます。それらを一度混合(プール)した後、また等分してそれぞれに異なるアミノ酸を結合させます。これを数回繰り返すことにより、多様なペプチドを一度に合成することが可能です。
腫瘍壊死因子TNF-αや転写因子NFAT等の標的分子に対し、数µMの解離定数を示す環状ペプチドを取得した例があります。
DNAコード化化合物ライブラリー
DNAコード化化合物ライブラリー技術は、DNAタグを有する化合物ライブラリーを混合物のまま標的と反応させ、PCRによるDNAタグの増幅、配列解析を経て結合化合物を同定する手法です。これらの2つの手法では、多様な化学構造や非天然アミノ酸を含むペプチドを合成・スクリーニング可能ですが、ライブラリー規模が低い一面を持ちます(上図c)。
Split intein Circular Ligation Of Peptides and ProteinS(SICLOPPS)
SICLOPPSは、分裂型インテインタンパク質のスプライシング機構を用いた環状ペプチドライブラリーの作製手法です(上図f)。タンパク質間相互作用の有無を知ることが可能な、逆ツーハイブリッド法等の評価系を用いて、細胞内における機能スクリーニングが可能という利点を有しています。
Macrocyclic organo–peptide hybrids(MOrPHs)・Bicyclic Organo-peptide Hybrids(BOrPHs)
インテイン-ペプチドを生合成し、化学反応により環状化したMacrocyclic organo–peptide hybrids(MOrPHs)やBicyclic Organo-peptide Hybrids(BOrPHs)も報告されています(上図g)。p53-MDM2/MDMX間相互作用の阻害設計を試みた例があります。
化学修飾によるペプチド医薬の機能化
ペプチドの特性を変化させる手法の1つとして、化学修飾があります。化学修飾が施されたペプチドの割合は年々増加しており、2010年以降に臨床研究が始まったペプチドのうち、約30 %は化学修飾されたペプチドです。その中でも、抗体のFc断片の融合/修飾や、脂質・PEGの付加が大部分を占めています。

Fc断片や脂質、PEGの修飾は、体内での血中半減期を伸ばすために用いられ、RomiplostimやLiraglutideは医薬品として承認されました(下表)。また、ペプチドに対し、放射性物質や細胞毒性を有する低分子化合物の化学修飾も試みられており、医薬品開発に重要なツールとなっています。その他にも、細胞透過性の向上を目指した膜透過性ペプチドの付加などが試みられています。

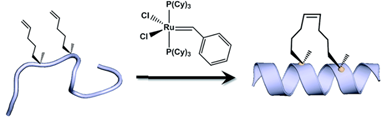
Stapledペプチド
腫瘍抑制因子p53の抑制因子であるMDM2とMDMXを阻害するALRN-6924は、炭化水素リンカーでペプチドを分子内架橋したStapledペプチドです。Stapledペプチドの合成には、ペプチド固相合成法が用いられます。α-メチル基(-CH3)とα-アルケニル基(-CnH2n-1)を含む2つのアミノ酸をペプチドに組み込み、これらのアミノ酸をオレフィンメタセシス等の化学反応により架橋しています。αヘリックス構造を安定化させることができ、細胞浸透性の向上効果が期待されています。
まとめ
今回は、注目されている割には体系化した記事が少ないペプチド医薬品についてまとめてきました。進化工学の発展により、10の13乗という膨大な規模の化合物群から、特定の機能を有するペプチドを同定可能なことが最大の強みと言えるでしょう。さらに、ライブラリーを一度作ってしまえばスクリーニングは自動で出来るため、迅速な化合物探索が可能であり、アンメットメディカルニーズへの取り組みが期待できます。
ペプチドの良いことばかり書いてきましたが、現段階では細胞内の標的を十分に狙えていないことや経口投与の実現性が低いことが課題として挙げられます。今後も目を離さず、動向を追っていきたいところです。